프로테아좀 저해제 (Preteasome inhibitor) 스토리
주) 큐리언트 남기연 대표이사
프로테아좀에 대한 소개를 어떻게 할까 생각하다가 떠오른 철학적이면서 현실적인 명제입니다. ‘세상 모든 것은 적절한 사라짐을 통해 항상성을 유지한다’는 것입니다. 평소 새로 생성되는 것에 더 많은 관심을 가지게 되는 것이 인지상정이지만, 실제로는 그 만큼 사라지는 것도 중요하다는 것입니다. 사람을 포함한 생명은 끊임없이 에너지를 소비하며 구조와 질서를 만들지만 결국 모든 것은 분해되어 무질서한 상태로 돌아가는 것이 열역학 제2법칙, 즉 엔트로피 ( Entropy) 증가 법칙에 따른 원리입니다.
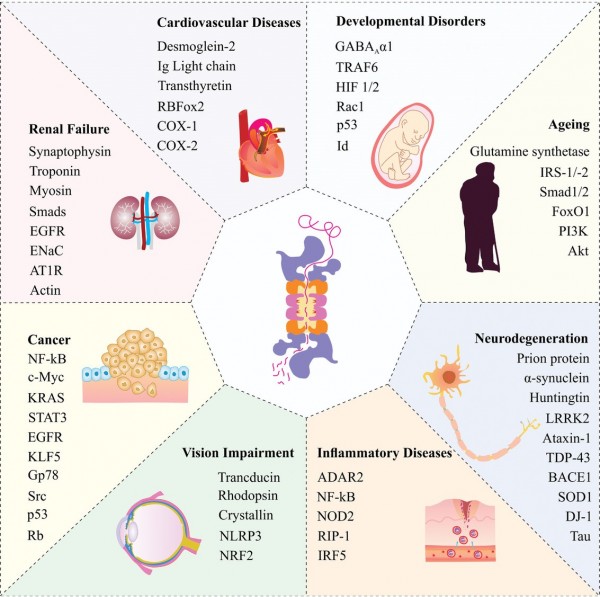
세포는 끊임없이 에너지를 소모하여 단백질을 생성하고, 세포가 살아가는 질서를 만들어 냅니다. 한 시대에 특정 기능을 위해 생성된 단백질은 그 기능을 다하고 사라져 다시 원 재료인 아미노산으로 돌아가 새로운 단백질 생산에 사용되어야 합니다. 단백질이 적절히 생성되고 적절히 사라지는 것이 세포의 항상성을 유지하는 키 (Key)가 되고 이 질서가 깨질 때 질병으로 이어 집니다. 암을 비롯한 많은 질환이 생성과 소멸의 항상성이 깨져 발생합니다. 프로테아좀 (Proteasome)은 세포 내 항상성 유지에서 사라지는 쪽을 담당하는 장치입니다. 수명을 다한 단백질에는 유비퀴틴 (Ubiqutin)이라는 재활용 폐기물 스티커와 같은 표시가 붙게 됩니다. 이렇게 유비퀴틴이 붙은 단백질은 여러 단계를 거쳐 프로테아좀으로 배달되고 최종 파기 됩니다. 어떤 질병은 파기될 단백질이 계속 유지되어 생기도 하고, 어떤 질병은 파기 되지 않아야 할 단백질을 조기 파기하여 생기기도 합니다. 여기에서 파기 되지 않아야 할 단백질의 조기 파기를 막는 것이 프로테아좀 저해제 입니다. (반대로 단백질이 파기 되도록 표시를 붙이는 화합물을 프로탁 (PROTAC, Proteolysis-targeting chimera)이라고 합니다. 프로탁에 대해서는 다음 기회에 설명하겠습니다.) 따라서, 프로테아좀 저해제는 파기 되지 말아야 할 단백질이 파기되어 생기는 질병을 치료하는 목적으로, 암을 비롯한 여러 질병에 쓰일 수 있는 일종의 플랫폼 기술이라 할 수 있습니다. 프로테오좀이 관계되는 질병은 아래 그림에서 보는 것과 같이 매우 다양합니다.
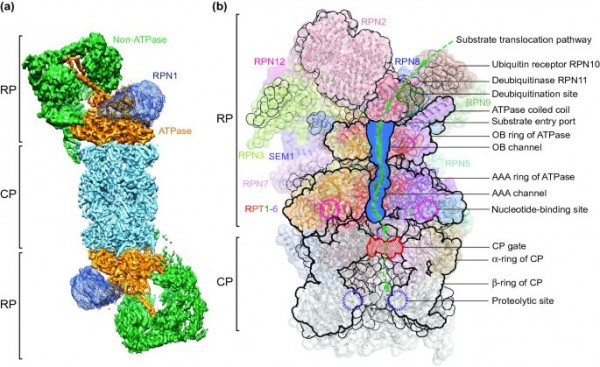
하지만 지금까지 개발된 프로테아좀 저해제는 다발성골수종 (Multiple Myeloma)에 한정되어 적용되고 있는 것이 현실입니다. 그 이유는 현재까지 개발되어 출시된 프로테아좀 저해제의 물성, 즉 화학물질의 구성에 따른 물리화학적 성질에 기인합니다. 프로테아좀은 수십개의 단백질이 모여 형성되는 거대한 구조체입니다.
이러한 거대 구조체를 저해하는 저분자 물질을 만드는 것은 매우 도전적인 일이였고, 현재까지 개발된 물질들은 조직 분포율이 낮고, 적혈구 침착도가 높은 등 일부 혈액암에만 적용될 수 있는 제한적 물성을 가지고 있었습니다. 프로테아좀 저해제가 사용될 수 있는 다양한 질환들을 생각해 보면 매우 안타까운 일입니다. 이러한 현실을 새로운 화학물질 구성을 가진 프로테아좀 저해제를 개발하여 해결하고자 하는 것이 QLi5 테라퓨틱스가 추진하는 프로테아좀 저해제 플랫폼입니다.
QLi5의 기반 기술은 탄탄한 구조생물학 (Structural Biology)에서 시작됩니다. 프로테아좀이 수십개의 단백질이 합쳐진 거대 구조체인 만큼 그 분자 구조를 알아내는 것도 쉽지 않았습니다. QLi5의 공동 설립자 중 한 분인 로버트 후버 (Robert Huber)박사님은 1988년 또다른 거대 구조인 엽록소 (Chlorophyll)의 분자구조를 규명한 공로로 노벨 화학상을 수상하신 분이고, 1994년 프로테아좀의 구조도 처음 규명하셨습니다. 전체 프로테아좀의 자세한 분자구조는 2018년에 와서야 규명 되었습니다. 막스플랑크 연구소의 후버 박사님은 프로테아좀의 자세한 분자 구조를 바탕으로 기존의 프로테아좀 저해제의 한계를 뛰어 넘을 수 있는 새로운 화학 구성의 물질의 기초 골격을 설계 했습니다. 완전히 다른 물성을 가져 혈액암 이외에도 다양한 용도로 적용이 가능한 프로테아좀 저해제 시리즈가 만들어진 것입니다. 새로운 시리즈 개발 후 후버 박사님은 프로테아좀이 어떤 가치가 숨어 있을지 기대되는 ‘보물상자 (Treasure Chest)’ 같다고 말씀 하시기도 했습니다. 실제로 QLi5는 새로운 시리즈를 바탕으로 다발성 골수종 이외의 다양한 혈액암, 그동안 프로테아좀 저해제가 쓰이지 못했던 고형암, 높은 안전성 기준이 필요한 자가면역 질환 등 다양한 적응증으로 여러가지 프로테아좀 저해제를 동시 개발하고 있습니다. 그 뿐만 아니라 QLi5의 프로테아좀 저해제는 항체-약물 접합체 (Antibody-Drug Conjugate, ADC)에서 약효를 발휘하는 약물 (payload)로 사용에 적합하여 그 효과가 기대되고 있습니다. 이렇게 다양한 경로로 개발되고 있는 QLi5의 프로테아좀 저해제 플랫폼은 다양한 질병 치료에 사용될 수 있는 진정한 보물상자로서 역할을 할 것으로 기대 됩니다.

 Blog
Blog